INFORME No 1
GRUPOS IV-V-VI-VII A DE LA TABLA PERIÓDICA DE LOS ELEMENTOS
-CONTENIDO-
- Introducción
- Tabla periódica
- Grupos en la tabla periódica
- Grupo IVA o Carbonoides
- Grupo VA o Nitrogenoides
- Grupo VIA o Calcogenos/ Anfigenos
- Grupo VIIA o Halògenos
-INTRODUCCIÓN-
Este trabajo tiene como fin dar a conocer la importancia , características , funciones etc de los elementos que conforman los grupos : IV - V - VI VII A de la tabla periódica , así como también se dará a conocer la formación y las propiedades presentadas en estos.
Se debe tener tener en cuenta que en la tabla periódica podemos llegar a encontrar una gran variedad de elementos , pero en esta ocasión nos centraremos en los correspondientes grupos ya antes mencionados.
OBJETIVO GENERAL
Identificar las propiedades , funciones , y características de los elementos de los grupo IV- V- VI-VIIA
de la tabla periódica , junto con su formación y propiedades destacables.
OBJETIVOS ESPECÍFICOS
- Reconocer la importancia de cada uno de los elementos químicos
- Diferenciar las funciones de estos
- Destacar las propiedades mas relevantes de cada grupo
MARCO TEÓRICO
LA TABLA PERIÓDICA
En la actualidad , la tabla periódica de los elementos químicos de obra de dos grandes químicos , el austriaco Friedich Adolf Paneth y el suizo Alfred Werner . En esta se clasifican los elementos hasta el momento conocidos ; esta clasificación se da en orden dependiendo del numero atómico de cada elemento , dadas en una estructura de 18 columnas y 7 filas . A estas filas se les denomina periodo y a las columnas grupos .
GRUPOS EN LA TABLA PERIÓDICA
Los grupos en la tabla periódica se denominan mediante números , los cuales van del 1 al 18 .
Los elementos que conforman cada grupo , tienen propiedades químicas similares entre si , aunque en algunos casos esto no es así . Esto es debido a que todos coinciden en su configuración electrónica .
CLASIFICACIÓN:
* Los grupos 1 y 2 están compuestos por los elemento metálicos .
* Los grupos del 3 al 12 se encuentran formados por los metales de transición .
* Los grupos del 13 al 17 están constituidos por los elementos no metálicos y metabólicos .
* El grupo 18 se constituye por los gases nobles .
GRUPO IVA O CARBONOIDES
Estos elementos forman mas de la cuarta parte de la corteza terrestre y solo podemos encontrarlo en su forma natural al C , Sn , Pb .
Estos elementos no suelen reaccionar con el agua , los ácidos reaccionan con el germanio , estaño y plomo las bases fuertes atacan a los elementos de este grupo , con la excepción del carbono desprendiendo hidrógeno reaccionan con el oxigeno formando óxidos .
ELEMENTOS QUE LO CONFORMAN
* CARBONO: Es un elemento que posee formas alotrópicas . Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que pueden formar largas cadenas , y su pequeño radio atómico le permite formar enlaces múltiples .
*SILICIO: El silicio es el segundo elemento mas abundante en la corteza terrestre . Se presenta de forma amorfa y cristalizada ; el primero es de un polvo parduzco , mas activo que la variante cristalina quien presenta en octaedros de color azul grisáceo y brillo metálico.
En su forma cristalina es muy duro y poco soluble , presenta un brillo metálico y color grisáceo. Aunque es un elemento inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halogenos.
En su forma cristalina es muy duro y poco soluble , presenta un brillo metálico y color grisáceo. Aunque es un elemento inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halogenos.
*GERMANIO: El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millón . Este elemento tiene una apariencia metálica, pero exhibe de un metal solo en condiciones especiales , dado a que esta localizado en la tabla periodo donde ocurre la transición de metales a no metales.
Forma un gran numero de compuestos organometalicos y es un importante material semiconductor utilizado en transistores y fotodetectores.
*PLOMO: La elasticidad de este elemento depende de las temperatura del ambiente , los cuales distienden sus átomos o los extienden.
Los compuestos de plomo mas utilizados en la industria son os óxidos de plomo , el tetraetilo de plomo y silicatos de plomo.
El plomo es un metal pesado y toxico , y la intoxico por este se denomina saturnismo o plumbosis.
Forma un gran numero de compuestos organometalicos y es un importante material semiconductor utilizado en transistores y fotodetectores.
*ESTAÑO: Es un metal maleable, que no se oxida y es resiste a la corrosión . Se encuentra en muchas aleaciones y se usa para recubrir a otros metales protegiéndolos de la corrosión .
Los compuestos de plomo mas utilizados en la industria son os óxidos de plomo , el tetraetilo de plomo y silicatos de plomo.
El plomo es un metal pesado y toxico , y la intoxico por este se denomina saturnismo o plumbosis.
GRUPO VA O NITROGENOIDES
Sus elementos poseen 5 electrones de valencia , por lo tanto , tienden a formar enlaces co-valentes y en ocasiones algunos forman enlaces ionicos.
PROPIEDADES
Ejemplo de reacción con H2:
N2 + 3H2 → 2NH3
El bismuto reacciona con O2 y con halógenos, formando bismita y bismutina entre otros compuestos.
A continuación se muestra una tabla con las características generales de estos elementos.
| Propiedad | N | P | As | Sb | Bi |
|---|---|---|---|---|---|
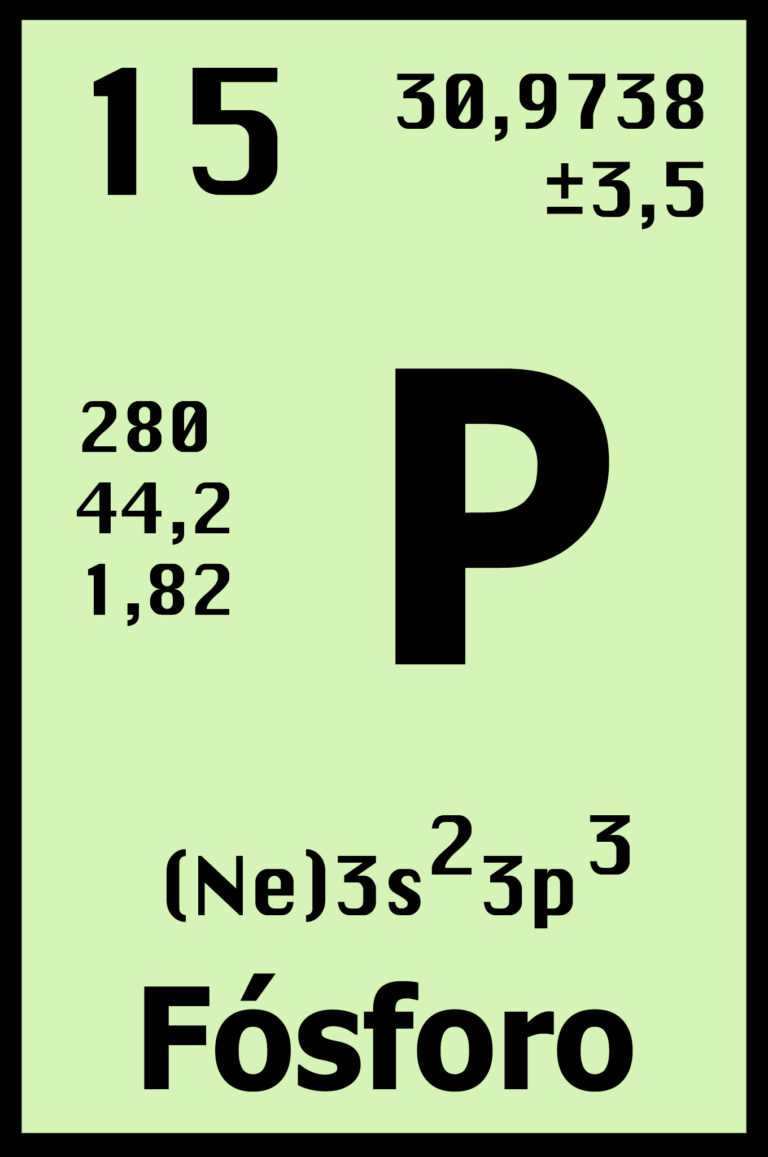
| Estructura electrónica externa | 2s² 2p³ | 3s² 3p³ | 4s² 4p³ | 5s² 5p³ | 6s² 6p³ |
| Densidad (kg/m³) | 1'25 (1) | 1.820 | 5.780 | 6.690 | 8.900 |
| Punto de fusión (°C) | -210 | 44 | 814 | 613 | 271 |
| 1ª Energía de ionización (kJ/mol) | 1.402 | 1.012 | 947 | 834 | 703 |
| Electronegatividad | 3'0 | 2'1 | 2'1 | 1'9 | 1'8 |
| Estados de oxidación comunes | -3, +5 | ±3, +5 | ±3, +5 | ±3, +5 | ±3, +5 |
ELEMENTOS QUE LO CONFORMAN
NITROGENO:El nitrógeno constituye el 78 % en volumen de la atmósfera. El nitrógeno es un elemento esencial en las proteínas de todos los animales y plantas. También se encuentra en la naturaleza en forma de amoníaco y sales amónicas, como resultado de la destrucción de la materia orgánica nitrogenada (putrefacción de materia natural y animal).
*FOSFORO: El fósforo, de símbolo atómico P, es un elemento abundante en la naturaleza.El fósforo es un componente esencial de los huesos y dientes de los animales. Los huesos están formados en su mayoría por fosfato de calcio Ca3(PO4)2.
ARSÉNICO: Es un elemento semimetálico sólido, de color gris metálico, que forma compuestos venenosos; se usa principalmente en la fabricación de vidrio para eliminar el color verde causado por las impurezas y en la fabricación de gases venenosos.
*ANTIMONIO: El antimonio es un elemento químico semimetálico que puede existir en dos formas: la forma metálica que es brillante, plateada, dura y quebradiza; y la forma no metálica que es un polvo gris. Es un mal conductor del calor y de electricidad, es estable en el aire seco y no es atacado por ácidos diluidos o álcalis.
*BISMUTO : Es el elemento más metálico en este grupo, tanto en propiedades físicas como químicas. El único isótopo estable es el de masa 209. Se estima que la corteza terrestre contiene cerca de 0.00002% de bismuto. Existe en la naturaleza como metal libre y en minerales
GRUPO VIA/ CALCOGENOS A ANFIGENOS
El grupo VIA del sistema Periódico o grupo del oxígeno está formado por los elementos: oxígeno, azufre, selenio, telurio, polonio.
Por encontrarse en el extremo derecho de la Tabla Periódica es fundamentalmente no-metálico; aunque, el carácter metálico aumenta al descender en el grupo .
Como en todos los grupos, el primer elemento, el oxígeno, presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa de valencia, sólo puede formar dos enlaces covalentes simples o uno doble, mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.
PROPIEDADES ATOMICAS
La configuración electrónica de los átomos de los elementos del grupo VIA en la capa de valencia es: ns2 np2+1+1. El oxígeno, cabeza de grupo, presenta, igual que en el caso del flúor, unas características particulares que le diferencian del resto (Principio de singularidad). Posibles formas de actuación:
* El oxígeno es un gas diatómico. El azufre y el selenio forman moléculas octa-atómicas S8 y Se8
* El telurio y el polonio tienen estructuras tridimensionales.
* El oxígeno, azufre, selenio y telurio tienden a aceptar dos electrones formando compuestos iónicos. Estos elementos también pueden formar compuestos moleculares con otros no metales, en especial el oxígeno.
* El polonio es un elemento radioactivo, difícil de estudiar en el laboratorio.
ELEMENTOS QUE LO CONFORMAN
OXIGENO : El oxígeno es el elemento más abundante en el planeta tierra. Existe en estado libre, como O2, en la atmósfera (21% en volumen), pero también combinado en el agua y formando parte diversos óxidos y oxosales, como silicatos, carbonatos, sulfatos, etc.
En condiciones ordinarias el oxígeno se presenta en dos formas alotrópicas, el dioxígeno y el ozono, de los cuales sólo el primero es termodinámicamente estable.
A diferencia del oxígeno, que se presenta en su variedad más estable como molécula diatómica O2 derivada de un enlace doble, los demás presentan estructuras derivadas de enlaces sencillos. Esto es debido a la disminución de la eficacia del solapamiento lateral a medida que aumenta el tamaño de el.
AZUFRE: El azufre se encuentra: nativo (en zonas volcánicas y en domos de sal) ó combinado, en sulfatos, sulfuros (sobre todo pirita, FeS2) y sulfuro de hidrógeno (acompañando al petróleo).
Variedades alotrópicas y sus propiedades físicas:
* En estado sólido.
Variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn).
* En estado líquido.
Anillos S8 y cadenas de longitud variable.
* En fase gas.
Cicloazufre, cadenas Sn (n = 3-10), S2
SELENIO: El selenio presenta tres formas alotrópicas:
* Se rojo: constituido por moléculas Se8.
* Se negro: anillos Sen con n muy grande y variable (forma amorfa).
* Se gris: de estructura similar a la del azufre plástico. Este alótropo presenta aspecto metálico (es un semimetal) y es fotoconductor.
TELURIO: Presenta una única variedad alotrópica, el Te gris, similar al Se gris. Tiene un carácter más metálico que el anterior.
POLONIO : Presenta dos alótropos: cúbico simple y romboédrico, en los que que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
CARACTER METALICO DEL GRUPO
Los elementos de este grupo muestran una transición paulatina desde las propiedades típicamente covalentes en la parte alta del grupo hasta las típicamente metálicas del elemento más pesado; y constituyen un excelente ejemplo de como los modelos de enlace covalente y metálico son, únicamente, casos extremos imaginarios de una situación real más compleja de interpretar. Este aumento se pone de manifiesto no solo en la variación progresiva de sus propiedades físicas y químicas sino también en cambios en sus estructuras.
REACTIVIDAD
* Oxígeno
- Reactividad con los principales elementos de la tabla periódica.
- Relación entre reactividad y estructura del elemento.
* Ozono
- Mayor re actividad del ozono, tanto desde el punto de vista termodinámico como cinético. La gran diferencia de re actividad entre los dos alótropos del oxígeno pone de manifiesto que las propiedades químicas dependen del estado elemental.
* Resto del grupo
La re actividad del resto de los cal-cógenos va siendo cada vez menor a medida que descendemos en el grupo.
- Re-actividad con elementos y compuestos.
- Re-actividad en disolución acuosa: se comportan como oxidantes bastante buenos debido a la general insolubilidad de los calcogenuros, que retiran de inmediato iones. El2- del medio, favoreciendo la reacción. - - También se pueden comportar como reductores, pasando a estados de oxidación formal positivos.
GRUPO VIIA O HALOGENOS
La configuración electrónica externa de sus átomos nos indica que les falta un solo electrón para completar el nivel y adquirir la estructura correspondiente al gas noble que le sigue en el Sistema Periódico. Por ello, forman iones negativos con gran facilidad. Presentan una gran re-actividad, siendo mayor en el flúor y disminuyendo conforme descendemos en el grupo.
PROPIEDADES
* Tienen las energías de ionización más elevadas y en consecuencia son los elementos más electronegativos.
Reaccionan fácilmente con los metales formando sales, rara vez están libres en la naturaleza, todos son gaseosos a temperatura ambiente menos el bromo que es líquido en condiciones ambientales normales.
* Su característica química más fundamental es su capacidad oxidante porque arrebatan electrones de carga y moléculas negativas a otros elementos para formar aniones.
ELEMENTOS QUE LO CONFORMAN
FLUOR: En el medio ambiente el flúor no puede ser destruído; solamente puede cambiar de forma. El flúor que se encuentra en el suelo puede acumularse en las plantas. La cantidad de flúor que tomen las plantas depende del tipo de planta, del tipo de suelo y de la cantidad y tipo de flúor que se encuentre en el suelo. En las plantas que son sensibles a la exposición del flúor incluso bajas concentraciones de flúor pueden provocar daños en las hojas y una disminución del crecimiento.
CLORO: El cloro se disuelve cuando se mezcla con el agua. También puede escaparse del agua e incorporarse al aire bajo ciertas condiciones. La mayoría de las emisiones de cloro al medio ambiente son al aire y a las aguas superficiales. Una vez en el aire o en el agua, el cloro reacciona con otros compuestos químicos. Se combina con material inorgánico en el agua para formar sales de cloro, y con materia orgánica para formar compuestos orgánicos clorinados.
BROMO: Los bromuros orgánicos son a menudo aplicados como agentes desinfectantes y protectores, debido a sus efectos perjudiciales para los microorganismos. Cuando se aplican en invernaderos y en campos de cultivo pueden ser arrastrados fácilmente hasta las aguas superficiales, lo que tiene efectos muy negativos para la salud de las daphnia, peces, langostas y algas.
YODO: El yodo puede ser radioactivo. Los isótopos radioactivos se forman de manera natural durante reacciones químicas en la atmósfera. La mayoría de los isótopos radioactivos del yodo tienen unas vidas medias muy cortas y se transformarán rápidamente en compuestos estables de yodo. Sin embargo, hay una forma radioactiva del yodo que tiene una vida media de millones de años y que es seriamente perjudicial para el medio ambiente. Este isótopo entra en el aire desde las plantas de energía nuclear, donde se forma durante el procesamiento del uranio y el plutonio. Los accidentes en las plantas nucleares han provocado la emisión de grandes cantidades de yodo radioactivo al aire.
ASTATO: El Ástato no se da en cantidades significativas en la biosfera, así que normalmente nunca presenta riesgos.
CONCLUSIÓN
Con este informe hemos identificado las grandes propiedades y características que posee cada uno de estos grupos junto con las características generales de cada elemento químico , a su vez su efecto al medio ambiente.
WEBGRAFIA
http://tpgrupoviia.blogspot.com/
https://es.wikipedia.org/wiki/Grupo_del_Carbono
https://es.slideshare.net/JaritzaGutierrezRome/grupos-viiviviv-a
https://www.ecured.cu/Grupo_VI_A
https://www.textoscientificos.com/quimica/nitrogeno
https://www.lenntech.es/periodica/elementos/sb.htm



















PUDO HABER CONSULTADO MAS 3,6
ResponderEliminarTRABAJO DE JUEGO 1,0
ResponderEliminarDEFINITVA 2,3
INFORME DE JUEGO 4,5
ResponderEliminarDEFINITIVA 4,0